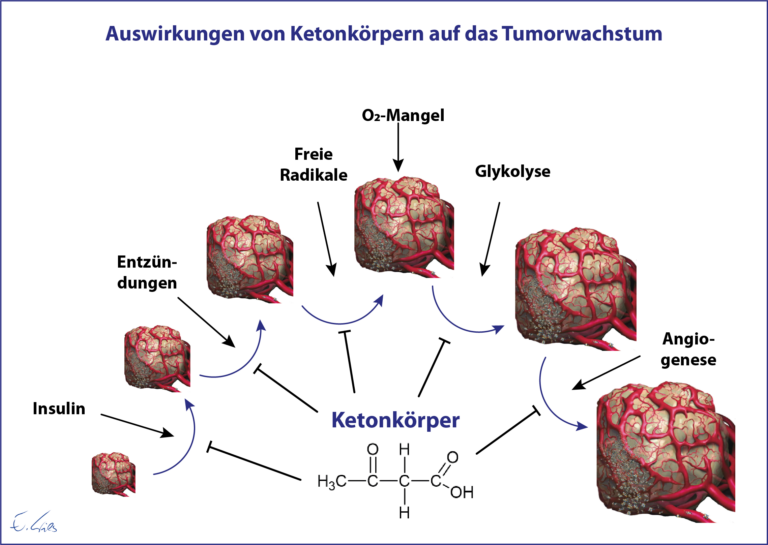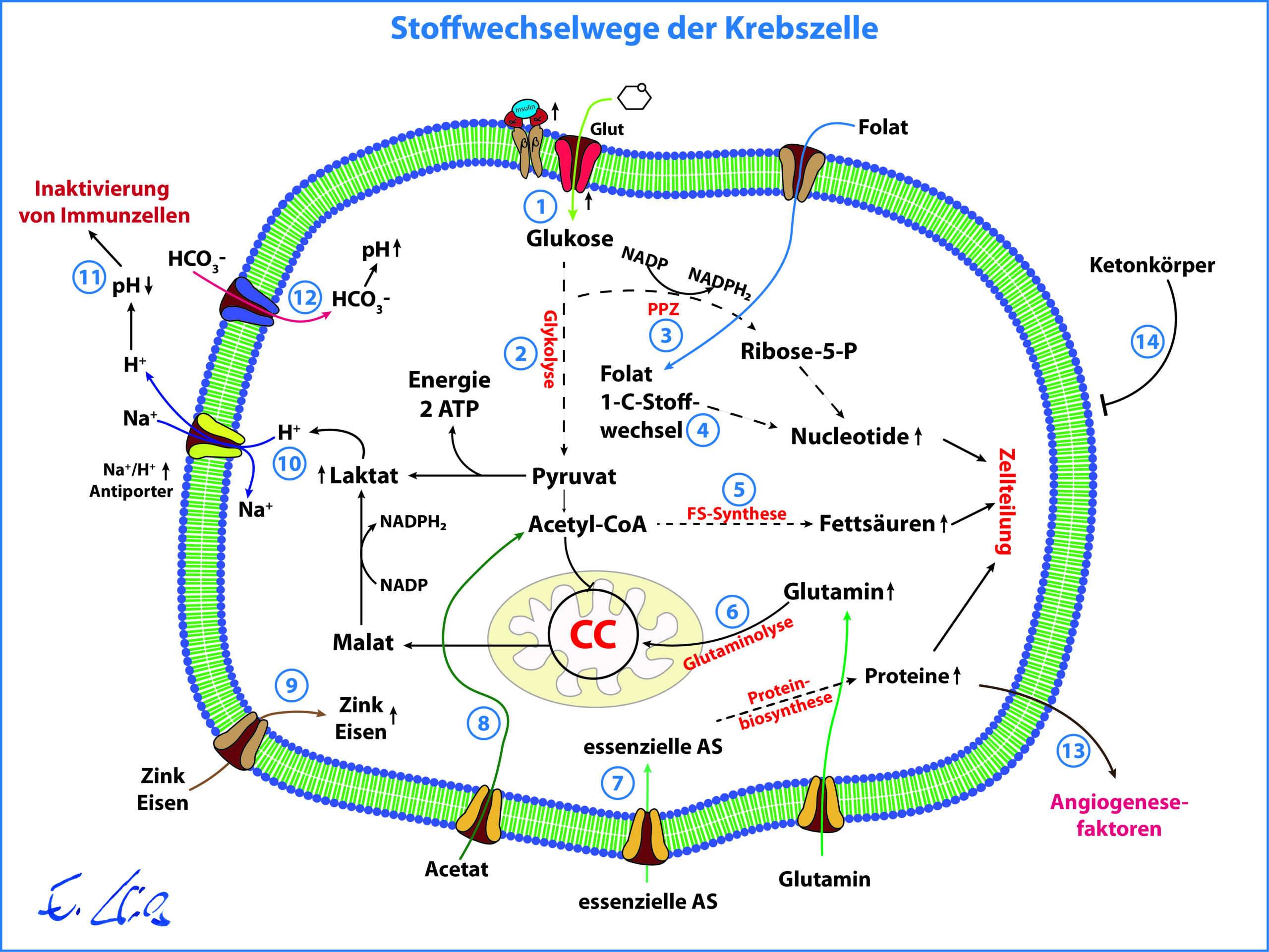
- Aus heutiger Sicht lässt sich der veränderte Stoffwechsel von Tumorzellen auf die Tatsache zurückführen, dass diese Zellen in besonderem Maße toxische Verbindungen wie Schwermetalle, PCB, Phthalate, Pestizide, etc. anhäufen, was zu einer besonderen genetischen Variabilität führen kann, um das Überleben der Zelle unter diesen Bedingungen weiter zu ermöglichen. Krebszellen haben durch den veränderten Stoffwechsel anderen Zellen ggü. enorme Überlebensvorteile und eine erhöhte Widerstandskraft. Die Veränderungen der Krebszellen sind somit spezifische Anpassungsreaktionen auf eine Akkumulation toxischer Verbindungen, die die Überlebens- und Zellteilungsrate erhöhen.
- Im Folgenden sollen die wesentlichsten Stoffwechselveränderungen der Tumorzelle aus Abbildung 1 erläutert werden.